Überzeugend praktisch: Der DUPIXENT®-Fertigpen jetzt bereits für AD-Patienten ab 2 Jahren zugelassen*
DUPIXENT® wird in Fertigspritze oder Fertigpen mit einem automatischen Sicherheitssystem zur einmaligen Anwendung bereitgestellt – auch zur Selbstinjektion.
.jpg)
%20(2).png)
Keine Voruntersuchungen1
%20(1).png)
Keine Laborkontrollen1
%20(1).png)
Keine klinisch relevanten Arzneimittel- Wechselwirkungen1
.png)
Selbstinjektion zu Hause1
Dosierung1 bei Atopischer Dermatitis
DUPIXENT® wird angewendet zur Behandlung von mittelschwerer bis schwerer Atopischer Dermatitis (AD) bei Erwachsenen und Jugendlichen ab 12 Jahren sowie bei Kindern ab 6 Monaten mit schwerer AD, die für eine systemische Therapie in Betracht kommen.1
Hinweis
Die entsprechenden Dosierungshinweise bei schwerem Asthma mit komorbider mittelschwerer bis schwerer Atopischer Dermatitis finden Sie in den aktuellen DUPIXENT® Fachinformationen.1
DUPIXENT® steht Ihnen als subkutane Injektion in einer Fertigspritze oder im Fertigpen zur Verfügung1,*
DUPIXENT® wird subkutan in den Oberschenkel oder das Abdomen injiziert, außer in einem Umkreis von 5 cm um den Bauchnabel herum. Falls die Injektion durch eine andere Person erfolgt, kann auch der Oberarm als Injektionsstelle ausgewählt werden.
Die Anfangsdosis von 400 mg bzw. 600 mg ist in zwei Injektionen zu je 200 mg bzw. 300 mg DUPIXENT® an zwei unterschiedlichen Injektionsstellen nacheinander zu verabreichen. Es wird empfohlen, bei jeder Injektion eine andere Injektionsstelle zu wählen. DUPIXENT® darf weder in empfindliche, verletzte oder vernarbte Hautstellen noch in Hautstellen mit blauen Flecken injiziert werden. Sofern angemessen kann DUPIXENT® nach Unterweisung durch den Patienten selbst oder durch eine Pflegeperson injiziert werden.
Jede Fertigspritze verfügt über ein automatisches Sicherheitssystem, welches automatisch nach der Injektion aktiviert wird. Dabei wird die Kanüle automatisch aus der Injektionsstelle gezogen und umhüllt. Der Fertigpen verfügt über eine Nadelabdeckung zum Schutz der Nadel. DUPIXENT® sollte im Kühlschrank bei Temperaturen zwischen 2 °C und 8 °C gelagert werden. Nicht über 25 °C lagern. Wenn der Umkarton dauerhaft aus dem Kühlschrank genommen werden muss, sollte das Datum der Entnahme in dem dafür vorgesehenen Bereich auf dem Umkarton notiert werden. Sobald DUPIXENT® aus dem Kühlschrank entnommen wurde, muss es innerhalb von 14 Tagen verwendet oder verworfen werden.
Der DUPIXENT®-Fertigpen ist nicht für die Anwendung bei Kindern unter 2 Jahren bestimmt. Für Kinder mit Atopischer Dermatitis im Alter von 6 Monaten bis 2 Jahren ist die DUPIXENT®-Fertigspritze die für die Anwendung in dieser Population geeignete Darreichungsform. Die Dosierungen von DUPIXENT® für die jeweilige Altersgruppe finden Sie in der aktuellen Fachinformation.
Injektion
Darreichungsformen1
DUPIXENT® wird in 200-mg- und 300-mg-Injektionslösung in Fertigspritzen mit automatischem Sicherheitssystem bzw. Fertigpens bereitgestellt und ist in Packungsgrößen zu 2 bzw. 6 Einheiten erhältlich.
Klare bis leicht opaleszierende, farblose bis blassgelbe sterile Flüssigkeit ohne sichtbare Partikel mit einem pH-Wert von ungefähr 5,9.
Der DUPIXENT®-Fertigpen ist nicht für die Anwendung bei Kindern unter 2 Jahren bestimmt. Für Kinder mit Atopischer Dermatitis im Alter von 6 Monaten bis 2 Jahren ist die DUPIXENT®-Fertigspritze die für die Anwendung in dieser Population geeignete Darreichungsform. Die Dosierungen von DUPIXENT® für die jeweilige Altersgruppe finden Sie in der aktuellen Fachinformation.
DUPIXENT® und Impfungen1,2
Mit DUPIXENT® behandelte Patienten können parallel inaktivierte oder Totimpfstoffe erhalten.
Studien belegten, dass die Antikörperreaktionen des TdaP-Impfstoffs und des Meningokokken-Polysaccharid-Impfstoffs im Dupilumab-Arm ähnlich wie im Placebo-Arm waren.2
Die zeitgleiche Anwendung von Lebendimpfstoffen und attenuierten Lebendimpfstoffen mit Dupilumab sollte vermieden werden, da die klinische Sicherheit und Wirksamkeit nicht erwiesen wurde. Es wird empfohlen, vor der Behandlung mit Dupilumab den Impfstatus von Patienten hinsichtlich Impfungen mit Lebendimpfstoffen und attenuierten Lebendimpfstoffen entsprechend den aktuellen Impfempfehlungen auf den neuesten Stand zu bringen. Es liegen keine klinischen Daten vor, die eine konkretere Empfehlung zur Verabreichung von Lebendimpfstoffen oder attenuierten Lebendimpfstoffen bei mit Dupilumab behandelten Patienten unterstützen.1
Auszug aus der aktuellen DUPIXENT® Fachinformation¹:
In einer Studie, in der Patienten mit Atopischer Dermatitis 16 Wochen lang einmal wöchentlich mit 300 mg Dupilumab behandelt wurden, wurden Immunantworten auf eine Impfung beurteilt. Nach einer 12-wöchigen Anwendung von Dupilumab wurden die Patienten mit einem TdaP-Impfstoff (T-Zell-abhängig) und einem Meningokokken-Polysaccharid-Impfstoff (T-Zell-unabhängig) geimpft. Die Immunantworten wurden 4 Wochen später beurteilt. Die Antikörperreaktionen auf sowohl den Tetanus-Impfstoff als auch den Meningokokken-Polysaccharid-Impfstoff waren im Dupilumab-Arm ähnlich wie im Placebo-Arm. In der Studie sind keine unerwünschten Wechselwirkungen zwischen den jeweiligen Totimpfstoffen und Dupilumab festgestellt worden.
Daher können mit Dupilumab behandelte Patienten parallel inaktivierte oder Totimpfstoffe erhalten.
Übersicht: Lebendimpfstoffe und mögliche Alternativen
(gemäß STIKO)3–5
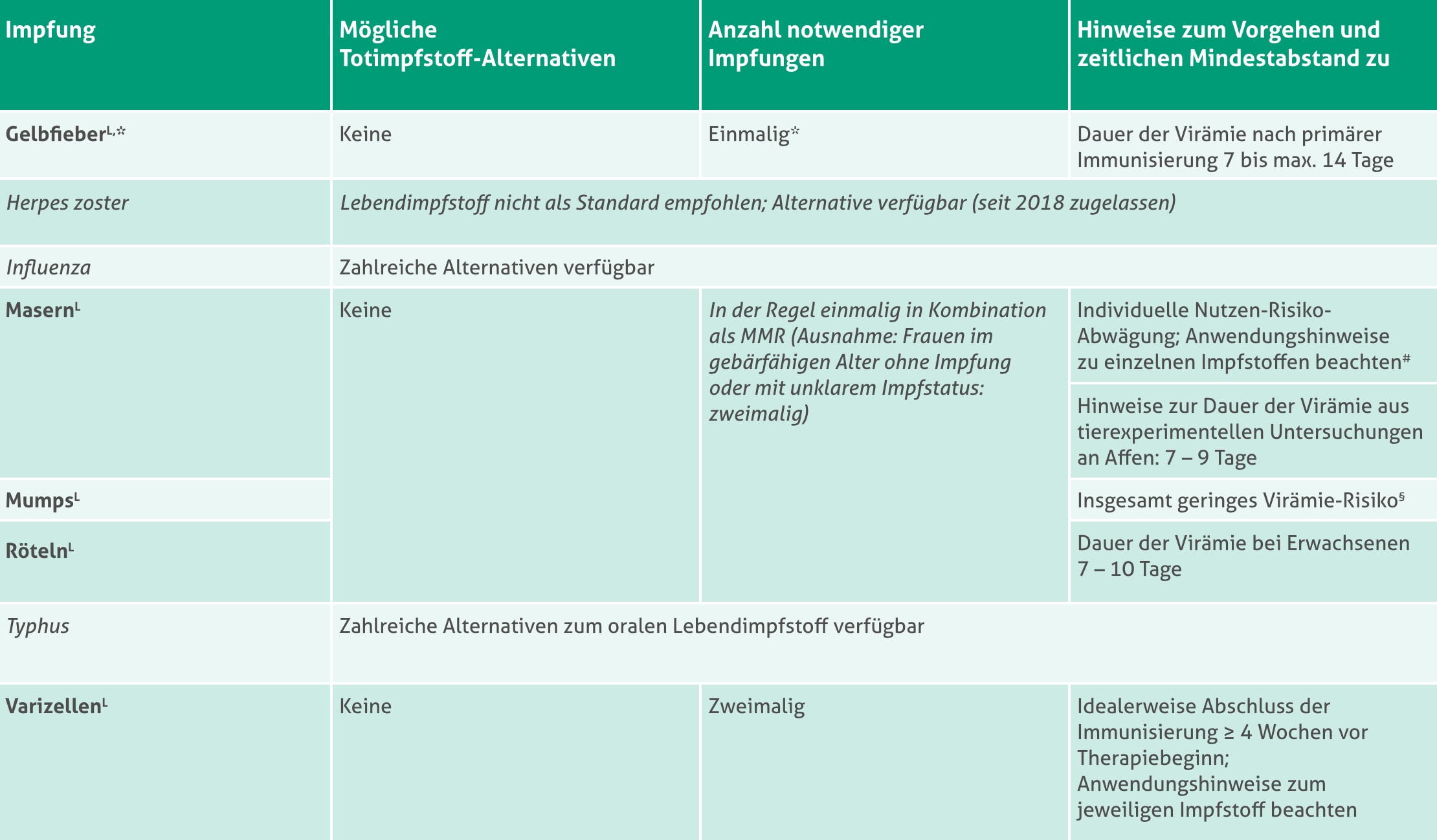
+ Zeitlicher Mindestabstand abhängig vom Behandlungsschema. Schätzungen der populationsbezogenen Pharmakokinetik-Analyse für mittlere Dauer der Abnahme der Dupilumab-Konzentration bis unter die untere Nachweisgrenze ab der letzten Steady-State-Dosis: 9 Wochen für das Behandlungsschema mit 200 mg alle zwei Wochen, 10–11 Wochen für Behandlungsschema mit 300 mg alle zwei Wochen.1
* Bei medizinischer Kontraindikation für die Gelbfieber-Impfung und Reisenotwendigkeit in Länder, die für die Einreise einen Impfnachweis fordern, kann die Möglichkeit einer Impfbefreiung in Betracht gezogen werden. In jedem Fall sollten Betroffene auf die Bedeutung einer Mückenstich-Expositionsprophylaxe hingewiesen werden.6
# Laut Expertenkonsens können Priorix® (MMR) und PriorixTetra® (MMR-V) im Einzelfall bei geringgradiger Immunsuppression nach individueller Nutzen-Risiko-Abwägung eingesetzt werden. Wichtig ist dann eine Aufklärung über Off-Label-Gebrauch.6
§ Hinweise auf potenzielles Risiko für aseptische Meningitis bei einigen Stämmen bis 2–3 Wochen.3
L Lebendimpfstoff ohne Totimpfstoff-Alternative.
Dupixent 200/300 mg Injektionslösung in einer Fertigspritze/im Fertigpen. Wirkstoff: Dupilumab. Zusammens.: Jede Fertigspritze/jeder Pen zur einmaligen Anwendung enthält 200 mg Dupilumab in 1,14 ml Lösung (175 mg/ml) oder 300 mg Dupilumab in 2 ml Lösung (150 mg/ml). Arzneil. wirks. Bestandt.: Dupilumab (vollst. humaner monoklon. Antikörper). Sonst. Bestandt. mit bek. Wirk.: Polysorbat 80 (E 433). Sonst. Bestandt.: Argininhydrochlorid, Histidin, Histidinhydrochlorid-Monohydrat, Natriumacetat-Trihydrat, Essigsäure, Saccharose, Wasser f. Injektionszw. Anw.-geb.: Mittelschw. bis schw. atopische Dermatitis (AD) b. Erw. u. Jugendl. ab 12 J., die für system. Ther. i. Betracht kommen. Schw. AD bei Kindern von 6 Mon. bis 11 J., die für system. Ther. i. Betracht kommen. Add-on-Erhaltungsther. b. Erw., Jugendl. ab 12 J. u. Kindern von 6–11 J. mit schwerem Asthma mit Typ-2-Inflammation (erhöhte Anzahl der Eosinophilen i. Blut u./od. erhöhtes FeNO), das trotz hochdosiert. (Kindern von 6–11 J.: mittel- b. hochdosiert.) ICS plus einem weiteren z. Erhaltungsther. angewendeten AM unzureich. kontrolliert ist. Zur Behandl. d. eosinophilen Ösophagitis (EoE) bei Erw., Jugendl. u. Kindern ab 1 J. m. einem Körpergew. v. mind. 15 kg, die mit einer konvent. medikament. Ther. unzur. therapiert sind, diese nicht vertragen od. für die eine solche Ther. nicht in Betracht kommt. Nur 300 mg: Add-on-Ther. m. intranasal. Kortikosteroiden z. Behandl. v. Erw. m. schwerer chron. Rhinosinusitis mit Nasenpolypen (CRSwNP), die m. system. Kortikosteroiden u./od. chirurg. Eingriff nicht ausreichend kontrolliert werden kann. Zur Behandl. von mittelschwerer bis schwerer Prurigo nodularis (PN) bei Erw., die für system. Ther. i. Betracht kommen. Add-on-Erhaltungsther. b. Erw. mit durch eine erhöhte Anzahl an Eosinophilen i. Blut gekennzeich. chronisch obstruktiver Lungenerkrankung (Chronic obstructive pulmonary disease, COPD), die trotz Kombinationsther. aus inhalativem Corticosteroid (ICS), langwirks. Beta-2-Agonisten (LABA) u. langwirks. Muskarinantagonisten (LAMA) od., falls ICS nicht angebracht ist, einer Kombinationsther. aus LABA und LAMA unzureich. kontrolliert ist. Gegenanz.: Überempfindlichk. geg. d. Wirkst. od. e. d. sonst. Bestandt. Nebenw.: Bei. Erw. m. atop. Dermatitis, Asthma, CRSwNP u. PN: Infekt./parasit. Erkrank.: Häufig: Konjunktivitis, oraler Herpes; Blut/Lymphe: Häufig: Eosinophilie; Immunsyst.: Selten: Serumkrankh./Serumkrankh. ähnl. Reakt., anaphylaktische Reakt.; Gelegentl.: Angioödem; Augen: Häufig: allerg. Konjunktivitis; Gelegentl.: Augenjucken, Blepharitis, Keratitis, trockenes Auge; Selten: ulzerative Keratitis; Erkr. Haut / Unterhautgew.: Gelegentl.: Ausschlag im Gesicht; Skelett/Bindegew./Knochen: Häufig: Arthralgie; Allgem./Beschw. a. Verabreichungsort: Häufig: Reakt. a. d. Injektionsst. (einschließlich Erythem, Ödem, Juckreiz, Schmerz, Schwellung), bei EoE u. COPD: Häufig: Bluterg. a. d. Injektionsst., bei COPD: Häufig: Induration, Ausschlag u. Dermatitis a. d. Injektionsstelle. Warnhinweis: Enthält Saccharose. Verschreibungspflichtig.
Pharmazeutischer Unternehmer: Sanofi Winthrop Industrie, 82 avenue Raspail, 94250 Gentilly, Frankreich.
Örtlicher Vertreter d. Zulassungsinhabers: Sanofi-Aventis Deutschland GmbH, 65926 Frankfurt am Main.
Stand der Information: November 2024
Weitere Informationen
-
für Fachkreise zu Prurigo nodularis
-
für Fachkreise zu schwerem Asthma
-
für Fachkreise zu chronische Rhinosinusitis mit Nasenpolypen
-
für Fachkreise zu Typ-2-Inflammation
-
ADVENT – die interdisziplinäre Forschungs und Wissensplattform von Sanofi
Allein aus Gründen der besseren Lesbarkeit wurde auf die gleichzeitige Verwendung geschlechtsspezifischer Sprachformen verzichtet. Sämtliche Personenbezeichnungen gelten aber selbstverständlich für alle Geschlechter.
-
DUPIXENT® Fachinformation, aktueller Stand.
-
Blauvelt A et al. J Am Acad Dermatol 2019; 80:158–167.
-
Papp KA et al. J Cut Med Surg 2019; 23:50–74.
-
Niehues T et al. Bundesgesundheitsbl 2017; 60:674–684.
-
Ständige Impfkommission: Empfehlungen der Ständigen Impfkommission (STIKO) beim Robert Koch-Institut – Epidemiologisches Bulletin 4/2023.
-
Wagner N et al. Bundesgesundheitsbl 2019; 62:494–515.