- Wissen
- Quelle: Campus Sanofi
- 16.07.2024
Diagnose und Epidemiologie der Eosinophilen Ösophagitis
Bei der Eosinophilen Ösophagitis (EoE) handelt es sich um eine immunvermittelte chronische Speiseröhrenentzündung mit einer prädominanten Eosinophilie.1 Ohne Behandlung kann die persistierende Inflammation der EoE zu Schäden des Ösophagusgewebes führen.2 Die EoE gilt als zweithäufigste entzündliche Erkrankung der Speiseröhre nach der gastroösophagealen Refluxkrankheit (GERD) und stellt die häufigste Ursache für eine Dysphagie und Bolusobstruktion bei Erwachsenen und Kindern dar.1,3,4
Was wissen wir über die Pathophysiologie der EoE?
Die Eosinophile Ösophagitis scheint progredient zu verlaufen, wobei ein zunächst inflammatorisch geprägter Verlauf in einen fibrostenosierenden Verlauf übergeht.1 Dabei kommt es zu histologischen und endoskopischen Veränderungen der Speiseröhre.2,5,6
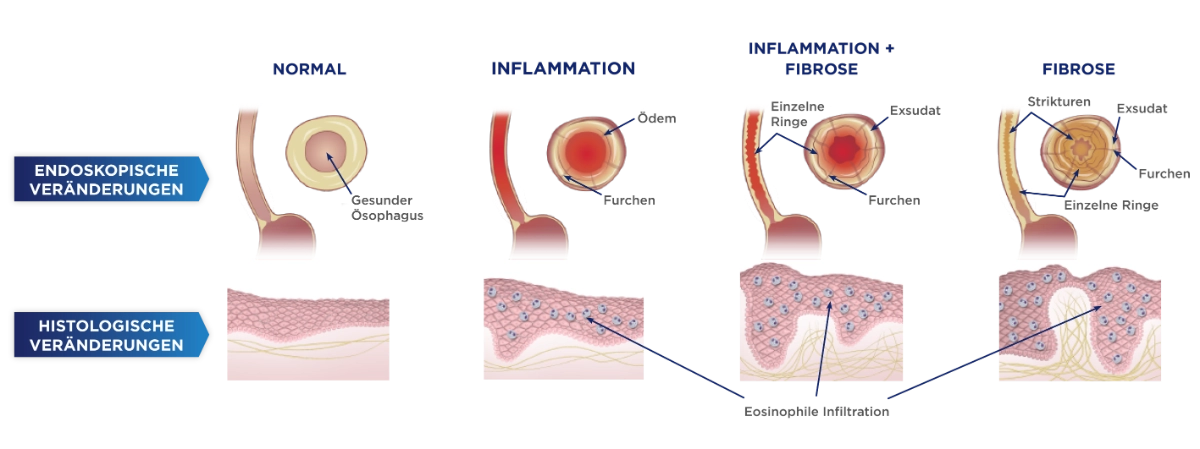
Modifiziert nach Dellon ES, Hirano I. Gastroenterology 2018; 154(2): 319–332
Die genauen Ursachen der Eosinophilen Ösophagitis sind noch nicht geklärt. Zwillingsstudien bestätigten eine schwache genetische Komponente bei der Entstehung der Erkrankung.1,7 Zudem scheinen Umweltfaktoren wie Kaiserschnittgeburt, Frühgeburt oder eine Antibiotikaexposition im Säuglingsalter eine starke Bedeutung zu haben.5 Studien deuten darauf hin, dass Kontakt zu Helicobacter pylori die Wahrscheinlichkeit reduziert, an EoE zu erkranken.8,9 Häufig bestehen bei Patienten* begleitende IgE-vermittelte Lebensmittelallergien oder eine Sensibilisierung gegenüber Aeroallergenen.1,10
Komorbidität: Andere Erkrankungen mit Typ-2-Inflammation
Etwa drei Viertel der Patienten mit Eosinophiler Ösophagitis leiden begleitend unter anderen Erkrankungen mit Typ-2-Inflammation, wie beispielsweise:11-14
%20(5).png)
Nahrungsmittelallergien

Allergische Rhinitis

Atopische Dermatitis
Asthma

Rhinosinusitis
Welche Beschwerden zeigen sich bei der Eosinophilen Ösophagitis?
Die entzündlichen Veränderungen in der Speiseröhre und die dadurch entstehende Fibrose kann bei Patienten mit Eosinophiler Ösophagitis allmählich zu einer Stenose führen.6 In der Folge kann es bei Erwachsenen zu folgenden Symptomen kommen, die die Lebensqualität beeinträchtigen:3,15,16

Dysphagie

Bolusobstruktion

Brustschmerzen

Regurgitation
Bei Kindern mit einer Eosinophilen Ösophagitis stehen dagegen andere Symptome im Vordergrund. Hier kommt es häufig zu refluxähnlichen Beschwerden, Übelkeit/Erbrechen sowie Nahrungsverweigerung und in besonders schweren Fälle sogar zu Wachstumsstörungen.1

Die Impaktion von Nahrungsmitteln ist eine direkte Folge der Fibrose der Speiseröhre und des Gewebeumbaus. Die Beseitigung einer Bolusobstruktion kann ein akuter Notfall sein, der einen dringenden endoskopischen
Eingriff erfordert.17,18

Änderungen im Essverhalten und in der Nahrungsauswahl können die Symptome der Eosinophilen Ösophagitis maskieren. Patienten essen aufgrund von Schluckbeschwerden z. B. sehr langsam, kauen sorgfältig, zerkleinern ihre Nahrung oder unterstützen den Schluckakt durch vermehrtes Trinken.5
Wie häufig ist die EoE?
Die Inzidenz und Prävalenz der Eosinophilen Ösophagitis ist stark angestiegen.3 In Europa erkranken jährlich 6 bis 13 von 100.000 Einwohnern daran.1 Die EoE kann Patienten jeden Alters betreffen, am häufigsten tritt sie in der Adoleszenz und bei Erwachsenen im Alter von 30 bis 50 Jahren auf. Männer erkranken 2- bis 3-mal häufiger an EoE als Frauen.1
Wie lässt sich die EoE diagnostizieren?
Der erste Abklärungsschritt bei Symptomen einer ösophagealen Dysfunktion ist eine gezielte Anamnese, die auch adaptives Essverhalten der Patienten und andere allergische Erkrankungen berücksichtigt. Zur objektiven Beurteilung von auftretenden Symptomen stehen sowohl für Erwachsene als auch für Kinder verschiedene validierte Fragebögen zur Verfügung.1
Haben Sie Dysphagiesymptome?
Der Dysphagiesymptom-Fragebogen (Dysphagia Symptom Questionnaire, DSQ) ist eine Möglichkeit, die Häufigkeit und Intensität von Dysphagie bei Patienten mit EoE zu erfassen.19 In diesem Fragebogen werden Dysphagiesymptome der letzten 24 Stunden abgefragt. Ein höherer Gesamtwert deutet auf häufigere und/oder stärkere Ereignisse der Dysphagie hin. Frage 1 ist unbewertet und Frage 4 ist eine alleinstehende Frage. Der DSQ-Score ergibt sich aus der Addition der täglichen Summen der Bewertung der Fragen 2 und 3 über einen Beobachtungszeitraum von 14 Tagen. Der maximale Wert, der starker und häufiger Dysphagie entspricht, ist 84.19

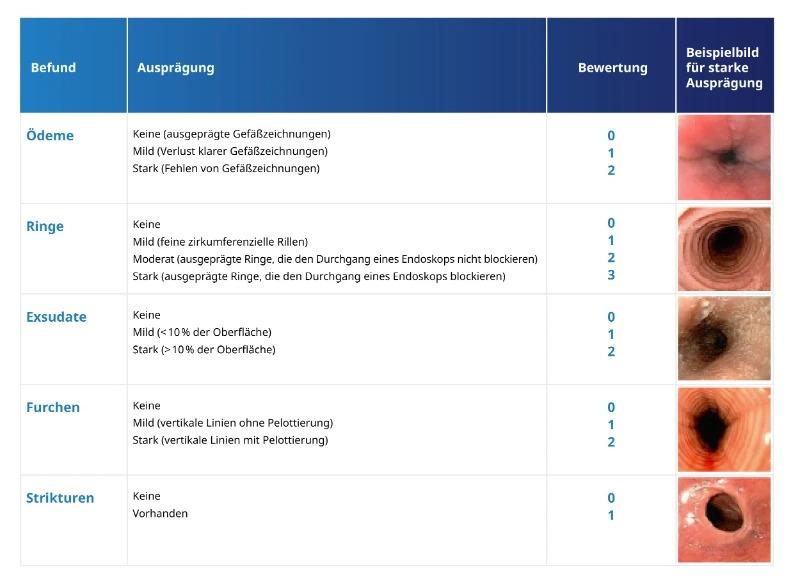
Bei der endoskopischen Untersuchung können sichtbare strukturelle Veränderungen der Speiseröhre auf eine Eosinophile Ösophagitis hinweisen. Eine ödematös bedingt blass wirkende Schleimhaut mit reduzierter Gefäßzeichnung, longitudinale Furchen und weißliche Exsudate sind Hinweise einer akuten Inflammation.1 Fixierte Ringbildungen, eine Verengung des Lumens und Ausbildung von Strikturen sowie eine starke Vulnerabilität der Schleimhaut bei der Endoskoppassage weisen bereits auf einen Gewebeumbau hin.1
Mithilfe des EREFS-Scores zur standardisierten Klassifizierung von endoskopischen Anzeichen für Eosinophile Ösophagitis können endoskopische Befunde interpretiert werden.20
Würden Sie EoE erkennen?
Mithilfe des EoE-Endoskopiereferenz-Scores (EREFS) lässt sich das Vorliegen und der Schweregrad von 5 endoskopischen Befunden zur aktiven Inflammation und fibrotischen Aktivität für die Diagnose von EoE standardisiert erfassen und klassifizieren.20 Der EoE-EREFS wird für jedes Drittel des Ösophagus separat bestimmt.
In den meisten Fällen korrelieren sowohl die Symptome als auch der endoskopische Befund nur unzureichend mit der Krankheitsaktivität. Daher sind zur Diagnosestellung mehrere Biopsien aus verschiedenen proximalen und distalen Abschnitten der Speiseröhre und deren histologische Untersuchung erforderlich.1
Das Vorliegen von mindestens 15 Eosinophilen pro Hauptgesichtsfeld# gilt als Grenzwert für die Diagnosestellung einer EoE.2 Der histologische Nachweis der Infiltration von Eosinophilen ermöglicht außerdem die Differentialdiagnose zur gastroösophagealen Refluxkrankheit (GERD). Um das mögliche Fortschreiten der Fibrose und damit verbundene chronische Komplikationen für Patienten mit Eosinophiler Ösophagitis zu verhindern, ist eine gezielte und zügige Diagnosestellung wünschenswert.
Wie wird EoE histologisch diagnostiziert?
Bei der Beurteilung histologischer Veränderungen muss sich nicht auf die Eosinophilendichte allein verlassen werden. Ein standardisiertes Verfahren zur Beurteilung von Ösophagusbiopsien ist das EoE-Histologie-Scoring-System (EoE-HSS).21 Gewebeproben werden auf 8 histologische Merkmale, die mit EoE in Verbindung stehen können, hin untersucht und anhand einer Skala von 0–3 klassifiziert (0 = normal; 3 = starke Ausprägung). Der Maximalwert des EoE-HSS beträgt 24.
Beurteilungskriterien von Ösophagusbiopsien des EoE-HSS21
- Eosinophilendichte
- Basalzonenhyperplasie
- Eosinophile Mikroabszesse
- Eosinophile in oberer Epithelzellschicht
- Erweiterte Interzellularräume
- Veränderung der epithelialen Oberfläche
- Dyskeratotische Epithelzellen
- Fibrose der Lamina propria

Bis zur korrekten Diagnose der Eosinophilen Ösophagitis kann es bis zu 10 Jahre dauern!11 Oft liegt dann bereits eine Schädigung der Speiseröhre vor, die bei frühzeitiger Diagnose möglicherweise hätte verhindert werden können.1,22
Referenzen
DSQ = Fragebogen zur Beurteilung von Dysphagie bei EoE-Patienten (dysphagia symptom questionnaire)
EoE = Eosinophile Ösophagitis
EoE-HSS = histologisches EoE-Klassifizierungssystem (histology scoring system)
EOS = Eosinophile
EREFS = endoskopischer EoE-Referenzscore (endoscopic reference score)
GERD = gastroösophageale Refluxkrankheit
IgE = Immunglobulin E
* Allein aus Gründen der besseren Lesbarkeit wurde auf die gleichzeitige Verwendung geschlechtsspezifischer Sprachformen verzichtet. Sämtliche Personenbezeichnungen gelten aber selbstverständlich für alle Geschlechter.
# Das Hauptgesichtsfeld ist der unter einem Lichtmikroskop sichtbare Ausschnitt eines Präparats.
Da die Größe dieses Ausschnitts abhängig vom Mikroskop unterschiedlich sein kann, kann auch die ösophageale Eosinophiliedichte (EOS/mm2) angegeben werden.
-
Miehlke S et al. Z Gastroenterol 2018; 56(2): 139–150
-
Miehlke S et al. Z Gastroenterol 2021; 59(8): 869–878
-
Lucendo AJ et al. United European Gastroenterol J 2017; 5(3): 335–358
-
Arias A et al. Aliment Pharmacol Ther 2016; 43(1): 3–15
-
Furuta GT, Katzka DA. N Engl J Med 2015; 373(17): 1640–1648
-
Dellon ES, Hirano I. Gastroenterology 2018; 154(2): 319–332.e3
-
Alexander ES et al. J Allergy Clin Immunol 2014; 134: 1084–1092.e1
-
Shah SC et al. Clin Gastroenterol Hepatol 2019; 17(11): 2185–2198.e3
-
Dellon ES et al. Gastroenterology 2011; 141(5): 1586–1592
-
Almansa C et al. Am J Gastroenterol 2009; 104(4): 828–833
-
Chehade M et al. J Allergy Clin Immunol Pract 2018; 6(5): 1534–1544.e5
-
van Rhijn BD, Bredenoord AJ. J Clin Gastroenterol 2017; 51(8): 659–668
-
Hill A et al. J Allergy Clin Immunol Pract 2018; 6(5): 1528–1533
-
Jyonouchi S et al. Immunol Allergy Clin North Am 2009; 29(1): 85–97
-
Gómez-Aldana A et al. World J Gastroenterol 2019; 25(32): 4598–4613
-
Klinnert MD et al. J Pediatr Gastroenterol Nutr 2014; 59(3): 308–316
-
Kuchen T et al. Allergy 2014; 69(9): 1248–1254
-
Straumann A, Safroneeva E. Curr Treat Options Allergy 2015; 2: 100–109
-
Hudgens S et al. J Patient Rep Outcomes 2017; 1(1): 3
-
Hirano I et al. Gut 2013; 62(4): 489–495
-
Collins MH et al. Dis Esophagus 2017; 30(3): 1–8
-
Schoepfer AM et al. Gastroenterology 2013; 145(6): 1230–1236.e1–2
MAT-DE-2202838-3.0-12/2023